Коэффициент аккомодации
Кристаллизацию следует рассматривать как двухстадийный процесс. На первом этапе происходит формирование, так называемых, кластеров, в приграничном кристаллизационном слое, на втором - их присоединение к фронту кристаллизации. При этой модели влияние специфических особенностей атомов примеси, присутствующих в расплаве железа, должно проявляться дважды:
- при формировании поверхностей кластеров, которые могут обладать различной степенью атомной шероховатости, в результате чего возникает различное число дефектов типа вакансий;
- при присоединении кластеров с различным качеством поверхности и числом дефектов к твердой поверхности, то есть различие строения поверхности кластера будет существенно влиять на вероятность его присоединения, а также на частоту возникновения дефектов типа дислокаций.
В качестве меры возмущающего влияния примеси на затвердевание может быть использована абсолютная величина разности коэффициентов аккомодации железа и примеси (рис. 1).
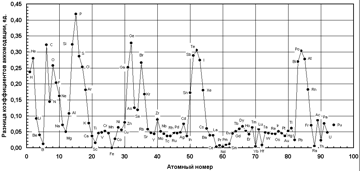
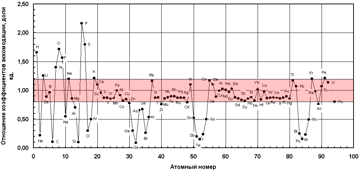
Как видно, наибольшее затрудняющее действие на процесс кристаллизации железа (и сплавов на его основе) могут оказывать следующие элементы: P, S, O, H, F, Ge, Si, C, Te, Po, Sb.
Физическая сущность коэффициента аккомодации раскрыта ниже.
Элементарный процесс плавления или затвердевания происходит тогда, когда атом (или кластер) на поверхности удовлетворяет одновременно трем требованиям:
1. обладает энергией, достаточной, чтобы перейти в активированное состояние;
2. имеет сообразно большую составляющую скорости по нормали к поверхности раздела;
3. имеет в другой фазе позицию, в которой сможет закрепиться.
Рассмотрим теперь эти три требования.
1. Пусть энергия связи на атом в твердом теле равна ES (S - от англ. "solid"), в жидком теле EL (L - от англ. "liquid"), а энергию активированного состояния, т. е. минимальную энергию, необходимую для перехода из твердой фазы в жидкую, обозначим через EA.
В твердой фазе доля поверхностных атомов, обладающих при температуре Т энергией, равной или превосходящей EA, пропорциональна ехр[-(EA - ES)/(k·T)], где разность (EA - ES) - тепловая энергия, необходимая для перехода каждого атома из твердой фазы в жидкую. Эту долю можно записать как exp[-QS-L/(R·T)], где - QS-L молярная (приходящаяся на один моль) энергия активации плавления. Аналогично доля атомов жидкости у поверхности раздела, обладающих достаточной для перехода из жидкой в твердую фазу энергией, равна ехр[-(EA - EL)/(k·T)], или ехр[-QL-S/(R·T)]. Поскольку скрытая теплота плавления равна разности энергий жидкой и твердой фаз, можно записать, что L = EL - ES или, если правильно выбрать единицы:
L = QS-L - QL-S = EA - ES - EA + EL = EL - ES (1)
Если частоту колебаний атомов в твердой фазе обозначить через vS, а в жидкости - через vL, и если энергию всякого последующего колебания считать независящей от энергии предыдущего, то ежесекундно атом приобретает необходимую для плавления энергию vS·ехр[-QS-L/(R·T)] раз; в случае затвердевания это число равно vL·ехр[-QS-L/(R·T)].
2. Определим геометрические факторы GL и GS как доли атомов, энергия которых такова, что составляющая их скорости по нормали к поверхности раздела достаточно велика, чтобы они покинули данную фазу.
3. Если атом обладает достаточной энергией и движется в нужном направлении, то он может найти надлежащую позицию на поверхности другой фазы. Это должна быть геометрически подходящая позиция, а атом должен немедленно передать часть своей энергии новым соседям посредством неупругого соударения. Если этого не случится, то атом вновь перейдет в активированное состояние и возвратится в прежнюю фазу. Вероятность того, что атом перейдет в другую фазу, называется коэффициентом аккомодации AL-S (вероятность перехода из жидкой фазы в твердую) или AS-L (вероятность перехода из твердой фазы в жидкую).
Тогда, ежесекундно все три условия удовлетворяются
1) AS-L·GL·vS·ехр[-QS-L/(R·T)] раз в случае плавления и
2) AL-S·GS·vL·ехр[-QS-L/(R·T)] раз при затвердевании.
Если на единичную площадь поверхности приходится со стороны твердой и жидкой фаз соответственно NS и NL атомов, то скорости плавления и затвердевания (выражающиеся числом атомов, ежесекундно пересекающих единичную площадку) составляют
RS-L = NS·AS-L·GL·vS·ехр[-QS-L/(R·T)]
RL-S =NL·AL-S·GS·vL·ехр[-QL-S/(R·T)]
Эти два процесса (плавление и затвердевание) считаются происходящими одновременно и независимо. Понятно, что если фактическая температура расплава выше температуры плавления/кристаллизации, то преобладает плавление, если же она не достигает равновесной, то превалирует затвердевание. В случае, когда температура равна TL-S, скорости этих двух процессов равны между собой.
В общем случае, результирующая скорость роста равна R' разности RL-S и RS-L и выражается в виде
R' = RL-S - RS-L = NL·AL-S·GS·vL·ехр[-QS-L/(R·T)] - NS·AS-L·GL·vS·ехр[-QS-L/(R·T)]
Характерно, что некоторые из параметров этого уравнения зависят от природы вещества и что, кроме того, NS и AL-S зависят еще от кристаллографической ориентации поверхности раздела. Из этого вытекает, что хотя величина TS-L для всех поверхностных ориентаций данного вещества, вероятно, одинакова, значение R' для заданного отклонения от равновесия должно быть, несомненно, различным.
Как уже было сказано, при равновесной температуре TS-L эти две скорости равны, т.е.
NL·AL-S·GS·vL·ехр[-QS-L/(R·T)] = NS·AS-L·GL·vS·ехр[-QS-L/(R·T)]
Откуда с учетом (1)
exp[L/(R·T)] = NS·AS-L·GL·vS/{NL·AL-S·GS·vL}
В случае плоской поверхности раздела твердая фаза - жидкость GL и GS приблизительно равны; почти равны между собой и NS с NL. Предположим также, что vS = vL, хотя Мотт и Джонс выдвинули доводы, подтверждающие, что это предположение должно быть ошибочным. При этих предположениях получаем, что
AS-L/AL-S = exp[L/(R·T)]
Таким образом, равновесная температура плавления / криталлизации должна быть пропорциональна скрытой теплоте плавления и зависеть еще от величины отношения двух коэффициентов аккомодации. Возможно, что коэффициент AS-L равен или близок к единице и что он одинаков для расплавов всех металлов и, быть может, даже для всех жидкостей. Тогда приближенно
AL-S = exp[-L/(R·T)]
Учитывая экспериментальные результаты Оррока и Чалмерса для различных кристаллических структур, убедительно демонстрирующих зависимость теплоты кристаллизации от температуры плавления, можно предположить, что величина AL-S является функцией этих взаимосвязанных величин и также зависит от кристаллической структуры твердой фазы и от кристаллографического характера поверхности.
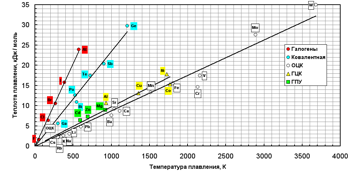
Таким образом, коэффициент аккомодации является функцией теплоты и температуры плавления. Кроме того, он практически функционально зависит от разницы индивидуальных физических характеристик элемента (величины заряда ядра, радиуса атома, взаимодействия между электронами в электрическом поле ядра), суммарно описываемых величиной потенциала ионизации.